3D打印三培養微纖維支架雙階段釋放二甲雙胍促骨血管神經再生
臨界尺寸骨缺損的再生是臨床難題,僅促進成骨不足,血管和神經支配對建立骨再生微環境至關重要,但現有支架多無法實現三者協同再生,且缺乏持續可控的釋放模式。傳統3D生物打印技術在構建三維組織修復支架方面存在局限性,且多數生長因子在促進骨再生的同時,難以兼顧神經和血管的生長調控。
來自首都醫科大學附屬北京口腔醫院的白玉興教授、張珂教授合作開發了3D生物打印水凝膠微纖維(aMF)包埋人牙周膜干細胞(hPDLSCs)的三培養體系(含hPDLSCs、人臍靜脈內皮細胞hUVECs和周細胞PCs),并將其整合到磷酸鈣水泥(CPC)支架中,構建了二甲雙胍雙階段釋放系統。該系統通過第一階段CPC釋放二甲雙胍招募內源性細胞建立初步微環境,第二階段aMF降解后釋放細胞與藥物,促進三培養細胞互作及血管神經生成。實驗證明,該支架顯著提升骨、血管、神經再生量(分別為對照組2.5倍、3倍、3.5倍),其機制與TRIM26基因調控的信號通路相關。
相關工作以“3D-printed microfibers encapsulating stem cells in scaffold with tri-culture and two-stage metformin release for bone/vasculature/nerve regeneration in rats”為題發表在《Bioactive Materials》上。

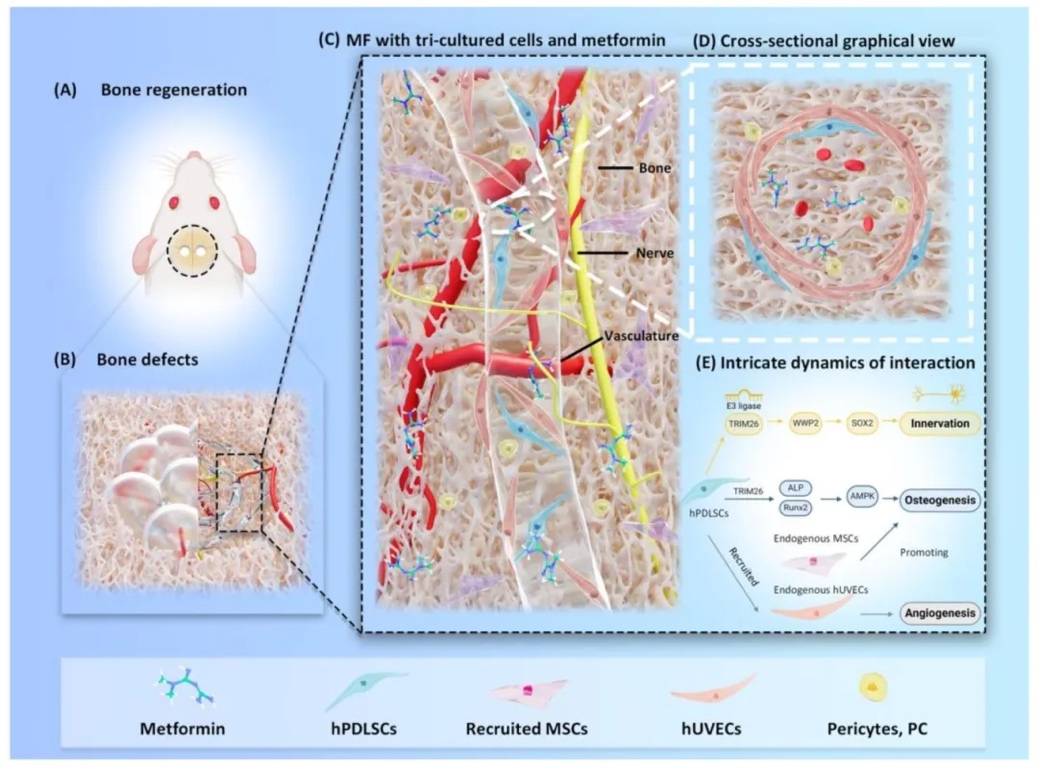
圖1.研究設計示意圖。(A) 3D 生物打印 aMF-CPC 支架已證明能夠修復臨界尺寸骨缺損。(B) 3D 生物打印 aMF-CPC 支架可促進骨骼、血管化和神經組織修復。(C) 基于 3D 生物打印人牙周膜干細胞(hPDLSCs)的三培養系統,該系統以 hPDLSCs 為基礎,包含人臍靜脈內皮細胞(hUVECs)和周細胞(PCs)。(D) 包含三培養細胞的長入血管橫截面圖示。(E) 三培養系統內發生的復雜相互作用動態。
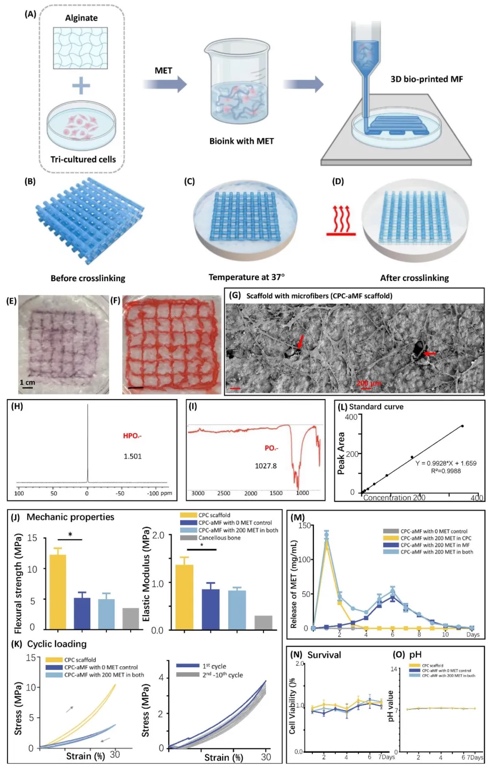
1. 3D生物打印微纖維-磷酸鈣水泥支架的設計與表征,通過FRESH技術與紫外固化工藝,制備了包埋人牙周膜干細胞(hPDLSCs)、人臍靜脈內皮細胞(hUVECs)和周細胞(PCs)的三培養體系支架,并整合二甲雙胍雙階段釋放系統。利用掃描電子顯微鏡(SEM)、傅里葉紅外光譜(FTIR)和原子力顯微鏡(AFM)分析支架結構,結果顯示其降解后形成100–300 μm大孔,力學性能(彎曲強度、彈性模量)優于松質骨,且二甲雙胍在CPC(階段一)和微纖維(aMF,階段二)中實現持續釋放,12天內累計釋放率達85%。
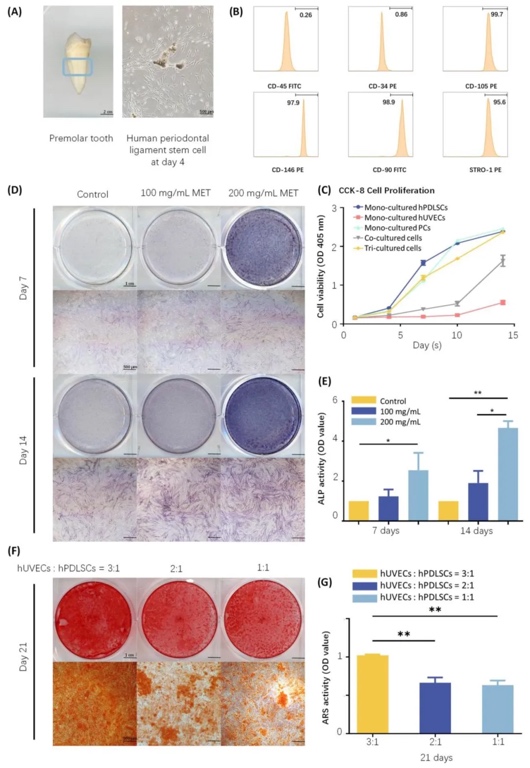
2. 三培養體系的體外細胞行為與成骨分化,通過免疫熒光染色(PECAM1、Desmin)和活/死細胞染色,觀察三培養細胞在微纖維中的分布與增殖。CCK-8實驗顯示,細胞比例為hPDLSCs:hUVECs:PCs=4:12:1時增殖活性最佳,堿性磷酸酶(ALP)活性和茜素紅染色(ARS)礦化結節量在200 mg/mL二甲雙胍作用下顯著提升,成骨基因(ALP、Runx2)表達上調2–3倍,證實三細胞互作協同促進成骨與血管生成。
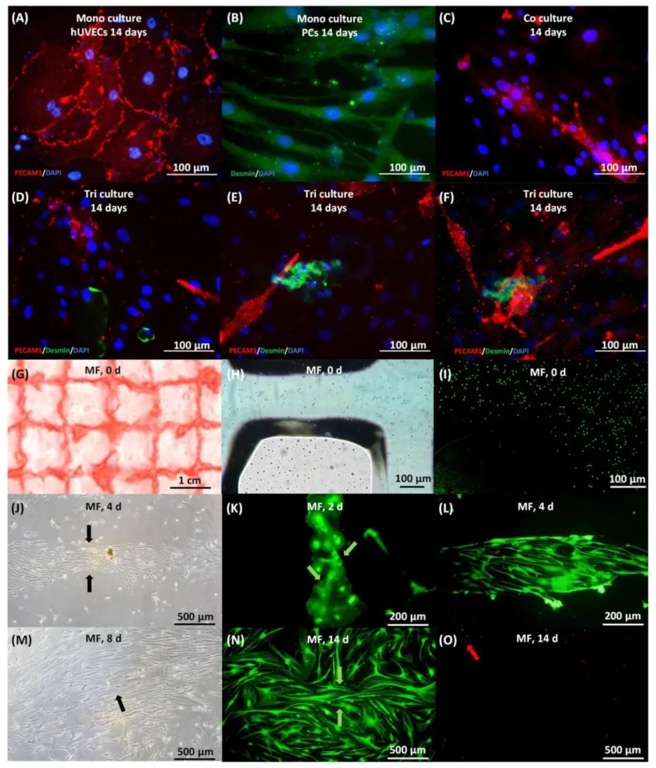
3. 細胞比例優化與體外成骨活性對比,通過設置不同hPDLSCs:hUVECs:PCs比例(如4:12:1、1:3:1),結合ALP染色和ARS礦化結節分析,篩選出最佳三培養比例為4:12:1,該比例下細胞成骨分化活性最高,礦化結節面積較單一培養組增加3.5倍,表明細胞間相互作用對再生效果至關重要。
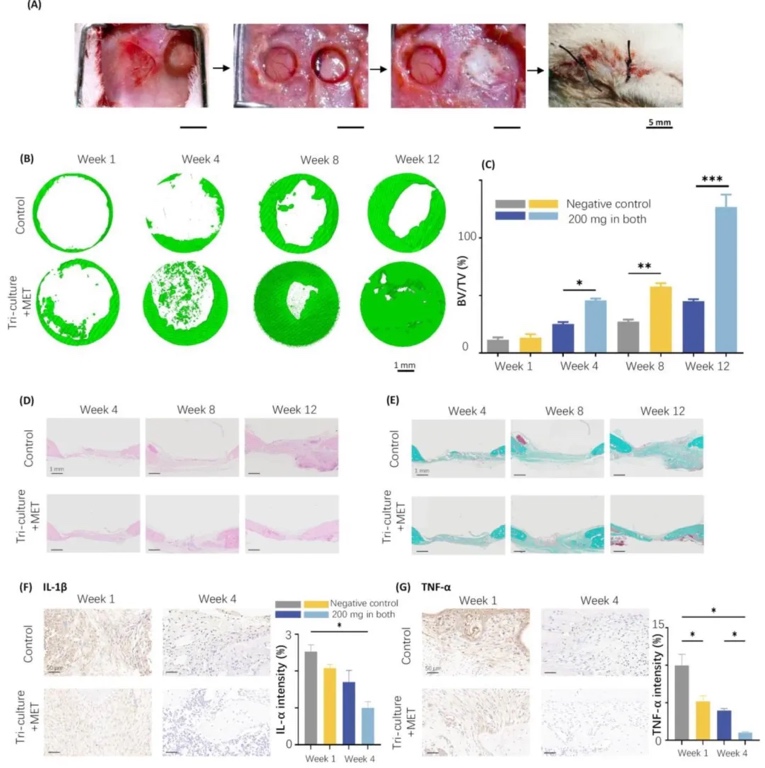
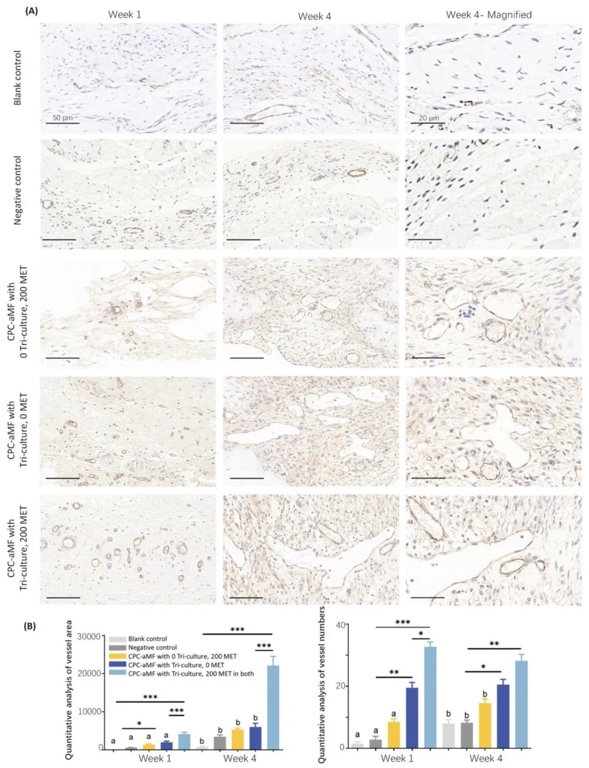
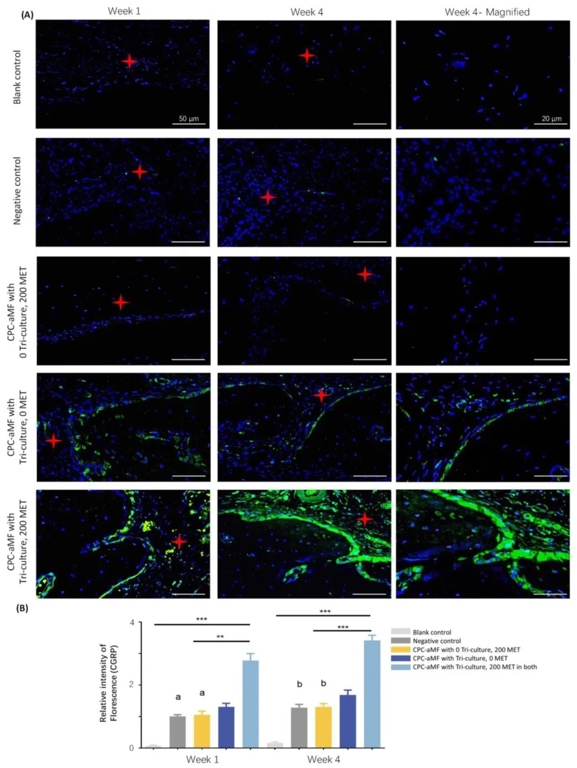
4. 體內骨缺損修復與血管神經再生評估,在大鼠顱骨5 mm缺損模型中植入支架,通過Micro-CT、HE染色、Masson染色及免疫組化(CD31、CGRP)分析。結果表明,術后12周時,三培養+雙階段二甲雙胍組的新生骨體積/組織體積(BV/TV)為陰性對照組的2.5倍,血管密度(CD31+)和神經纖維密度(CGRP+)分別提升3倍和3.5倍,炎癥因子IL-1β、TNF-α表達降低60%以上,顯示支架顯著促進骨、血管、神經協同再生。
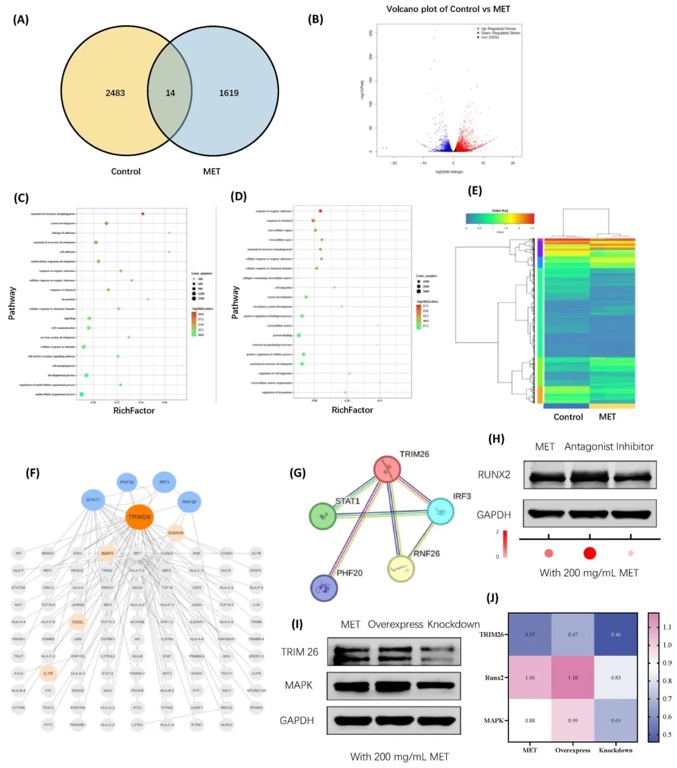
5. TRIM26基因調控機制與信號通路解析,運用RNA測序和蛋白質免疫印跡(Western blot),發現二甲雙胍顯著上調TRIM26基因表達(log2FC=1.8),激活cAMP-MAPK通路并促進Runx2蛋白表達。抑制或敲低TRIM26后,成骨和血管生成相關指標顯著下降,證實TRIM26是調控三組織再生的關鍵因子,其機制與神經營養因子通路協同作用相關。
研究結論
本研究開發了基于人牙周膜干細胞的三培養體系,并構建了3D生物打印微纖維-磷酸鈣水泥(aMF-CPC)支架,實現了二甲雙胍的雙階段釋放及骨、血管、神經組織的協同再生。實驗表明,該支架通過三培養細胞間的復雜相互作用(hPDLSCs、hUVECs、PCs),顯著提升了成骨、血管生成和神經支配能力:與陰性對照組相比,術后12周新生骨量增加2.5倍,血管和神經 ingrowth 分別提升3倍和3.5倍。機制研究發現,E3泛素連接酶TRIM26通過調控cAMP-MAPK信號通路參與這一過程。此外,支架具備良好的生物相容性、力學穩定性及可控降解特性,為顱骨等臨界尺寸骨缺損的修復提供了新策略,在口腔頜面及骨科再生領域具有潛在應用價值。
文章來源:
https://doi.org/10.1016/j.bioactmat.2025.05.011
(責任編輯:admin)


 澳大利亞冷噴涂技術企業Ti
澳大利亞冷噴涂技術企業Ti 3D Systems與NASA等多家機
3D Systems與NASA等多家機 鄭州輕工業大學ESM綜述!3
鄭州輕工業大學ESM綜述!3 Fathom強勢回歸,推出Edge
Fathom強勢回歸,推出Edge 自動化供應商柯馬加速布局
自動化供應商柯馬加速布局 美國空軍2860萬美
美國空軍2860萬美 美國軍工企業強強
美國軍工企業強強 美國斥資450萬美
美國斥資450萬美 GoEngineer通過收
GoEngineer通過收 3D食品打印:烹
3D食品打印:烹 卡內基梅隆研究人
卡內基梅隆研究人

