中南大學趙瑞波:乳酸功能化3D打印PCL/nHA 支架驅動BMSC成骨
大尺寸骨缺損的修復面臨巨大臨床挑戰,自體移植和異體移植存在供體短缺、免疫并發癥及感染風險等問題,組織工程策略雖有潛力,但在實現持續成骨誘導并與宿主微環境代謝兼容方面仍未達標。
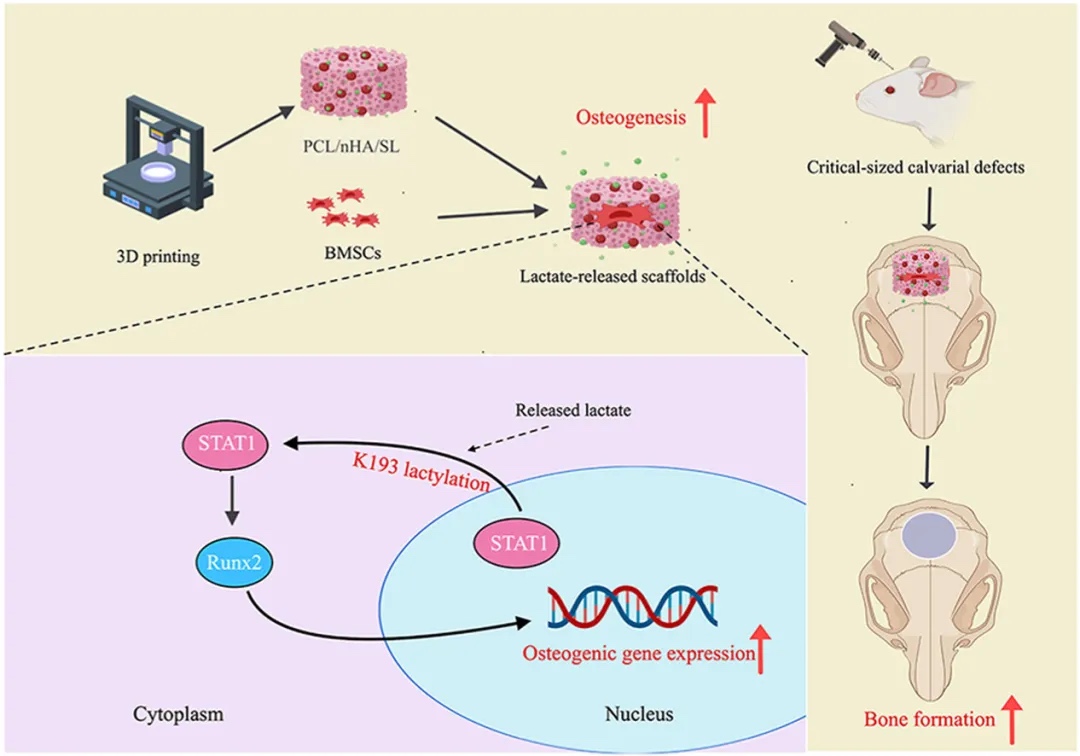
來自中南大學的趙瑞波教授團隊研發了一種乳酸功能化的3D打印聚己內酯/納米羥基磷灰石支架(PCL/nHA/SL),該支架將結構支撐與代謝-表觀遺傳調節相結合,能促進骨髓間充質干細胞(BMSC)的黏附、增殖和成骨分化,通過誘導STAT1的賴氨酸乳酸化修飾,改變其亞細胞定位,釋放RUNX2以激活成骨轉錄程序,在體內可驅動大尺寸缺損處的功能性骨再生。
相關工作以“Lactate-functionalized 3D-printed PCL/nHA scaffold drives BMSC osteogenesis via metabolic-epigenetic crosstalk”為題發表在《Materials Today Bio》上。
研究要點
支架制備與優化
制備 3D 打印 PCL/nHA/SL 支架,篩選出 1% 乳酸為最優濃度,評估其生物相容性。
成骨分化能力驗證
檢測支架對 BMSC 礦化、ALP 活性及成骨標志物的提升作用。
乳酸化修飾機制探究
通過蛋白組學發現 STAT1-K193 乳酸化,明確其為成骨調控關鍵靶點。
STAT1 乳酸化功能驗證
證實 K193 乳酸化調控 STAT1 亞細胞定位,解除對 RUNX2 的抑制。
體內骨再生效果評估
在大鼠顱骨缺損模型中,驗證支架促進功能性骨再生的能力。
文章來源:https://doi.org/10.1016/j.mtbio.2025.102101
(責任編輯:admin)


 布萊頓大學最新研究:用3D
布萊頓大學最新研究:用3D 經太空驗證:Horizon涂層3
經太空驗證:Horizon涂層3 能向任意方向行駛,國外博
能向任意方向行駛,國外博 3D打印骨軟骨譜系特異性雙
3D打印骨軟骨譜系特異性雙 ORNL與JuggerBot 3D合作開
ORNL與JuggerBot 3D合作開 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強

